Wiedza z zakresu zgodności z GxP
Obszar wiedzy GxP Basics odpowiada na pytania dotyczące zgodności z GxP. Znajdziesz tu informacje na temat odpowiednich norm i wytycznych oraz wymagań dotyczących dokumentacji zgodnej z GMP.
Tutaj znajdziesz odpowiedzi na następujące pytania:
- Co to jest GxP?
- Jakie normy i wytyczne odgrywają rolę w środowisku GMP?
- Które branże działają w środowisku regulowanym GMP?
- Jakie wymagania musi spełniać dokumentacja zgodna z GMP?
- Jak definiuje się zarządzanie ryzykiem w WYTYCZNYCH ICH Q9?
- Jakie są zasady zarządzania ryzykiem w obszarach regulowanych GxP?
- Jakie są cele zarządzania ryzykiem w obszarach regulowanych GxP?
- Która metoda jest odpowiednia do analizy ryzyka firm z wymaganiami zgodności z GxP?
Co oznacza "GxP"?
Przegląd najważniejszych przepisów w środowisku GMP:
- GxP jest terminem parasolowym dla określonych podobszarów regulowanych
- GMP, takich jak: GMP = Dobra Praktyka Produkcyjna
- GSP = Dobra praktyka w zakresie przechowywania danych
- PKB = Praktyka dystrybucji Goof
- GEP = Dobra Praktyka Inżynierska
- GAMP = Dobra Zautomatyzowana Praktyka Produkcyjna
Jakie normy i wytyczne odgrywają rolę w środowisku GMP?
Przegląd najważniejszych przepisów w środowisku GMP:
- Przepisy krajowe dla Niemiec: Ustawa o lekach (AMG) / Rozporządzenie w sprawie produkcji leków i składników aktywnych (AMWHV)
- Przepisy UE: Wytyczne GMP UE część I-III wraz z załącznikami
- Przepisy amerykańskie: Kodeks przepisów federalnych FDA (CFR)
- Przepisy międzynarodowe: ICH-Guidelines, PIC/S-Guides, ISPE Guides
Które branże działają w środowisku regulowanym GMP?
Branże te muszą być zgodne z wytycznymi i normami GMP:
- Przemysł farmaceutyczny
- Medyczny
- Nauki przyrodnicze i biotechnologia
Jakie wymagania musi spełniać dokumentacja zgodna z GMP?
Dokumentacja zgodna z GMP musi spełniać następujące wymagania:
- Musi mieć formę pisemną.
- Musi być poprawny i kompletny.
- Musi być jasno sformułowany i zawsze aktualny.
- Musi być zawsze dostępny.
- Dokumentacja musi być zatwierdzona i podpisana przez odpowiedzialnego urzędnika ds. jakości.
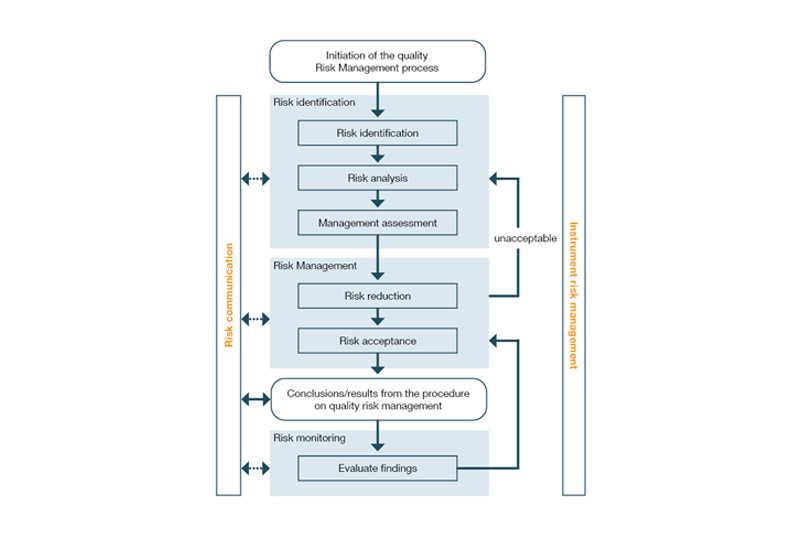
Jak definiuje się zarządzanie ryzykiem w WYTYCZNYCH ICH Q9?
Proces zarządzania ryzykiem jest opisany w wytycznej ICH Q9, która jest mocno zakorzeniona w części III wytycznych GMP UE. Ich celem jest ustanowienie kompleksowego procesu oceny ryzyka, zarządzania i monitorowania (patrz rysunek poniżej) w całym cyklu życia produktu, a tym samym kontrolowanie potencjalnych błędów i zagrożeń dla jakości produktu. Wiele z tych środków jest określanych w ramach analiz ryzyka (e.B. FMEA) i wdrażanych w trakcie kwalifikacji i walidacji. Dlatego w środowisku GxP często mówi się o kwalifikacji opartej na ryzyku i walidacji opartej na ryzyku.
Jakie są zasady zarządzania ryzykiem w obszarach regulowanych GxP?
Należy przestrzegać następujących zasad:
- Ocena ryzyka dla jakości powinna opierać się na dowodach naukowych i zawsze powinna być postrzegana w kontekście ochrony pacjentów
- Poziom wysiłku, formalności i dokumentacji procedury zarządzania ryzykiem jakości powinien być dostosowany do poziomu ryzyka
Jakie są cele zarządzania ryzykiem w obszarach regulowanych GxP?
- Należy odkryć słabe punkty i zagrożenia związane z jakością produktu i bezpieczeństwem pacjentów
- Decyzje powinny być podejmowane racjonalnie i zrozumiale
- Środki kontroli jakości i kierowania powinny być określone w oparciu o ryzyko
- Interdyscyplinarna wymiana w celu lepszej identyfikacji ryzyka, która ma być promowana
- Błędów należy proaktywnie i prewencyjnie unikać lub kontrolować
- Procesy decyzyjne stają się przejrzyste dla wszystkich zaangażowanych stron, tj.B także wobec organów
Która metoda jest odpowiednia do analizy ryzyka firm z wymaganiami zgodności z GxP?
Do analizy ryzyka często stosuje się metodę FMEA (FMEA = Failure Mode and Effects Analysis). Zaletą tego jest to, że może również przedstawiać bardzo obszerne rozważania w uporządkowany sposób. Jednak pomocne może być również, szczególnie w przypadku bardziej złożonych procesów lub roślin, aby najpierw użyć metod burzy mózgów, takich jak diagram Ishikawy lub diagram jodełki.